⚛️ Organisation atomique et moléculaire du vivant
La composition atomique du vivant
Les éléments chimiques sont l'ensemble des atomes ou d'autres entités qui présentent un nombre
- Les macroéléments, disponibles en grande proportion (par exemple C, H, O, N, P, S).
- Les oligoéléments, éléments beaucoup moins présents dans la nature mais indispensables pour certaines réactions (tel que le Fer, Zinc, Cuivre) et donc indispensables dans notre corps.
Manquer de vitamines ou d'oligoéléments peut être létal : exemple du Scorbut pour la vitamine C.
Ces éléments sont souvent à l'état dissous et ionisé. Mais ils peuvent également être sous état complexés, par exemple pour le fer dans l'hémoglobine.
Rappels chimie : atomes et molécules
Atomes et ions monoatomiques
Tableau Periodique
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
Lanthanoïdes
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
Actinoïdes
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
- Les Gaz Parfaits qui possèdent des couches complètes d'électrons.
- Les électropositifs, tout à gauche, possèdent une dernière couche avec uniquement un électron (alcalins).
- Les Métaux.
- Les électronégatifs (halogènes, chalcogènes).
Notion de molécules
Les ions sont divisés en deux catégories : les cations (positifs) et les anions (négatifs).
Cation resemble à cat et les chats c'est cool. Donc positif
Anion resemble à onion et les onions font pleurer. Donc négatif.
Les molécules sont les agencements de plusieurs atomes. Ils peuvent être liés de manière différentes :
- Liaisons covalentes : mise en commun d'éremsemblelectrons entre plusieurs atomes. Elles peuvent être simples ou doubles. La répartition des électrons rend les molécules polaires (une charge partielle est sur un/des atomes qui la compose, tel que l'Eau). Alors, les molécules vont s'orienter dans certains sens en fonction de leurs polarités et créer des liaisons faibles. Dans l'autre cas, elle est apolaire et ces interactions avec les autres molécules sont limitées.
- Liaisons faibles : liaisons hydrogènes, ioniques, interactions de Van der Waals et interactions hydrophobes. Elles sont moins énergétiques que les liaisons covalentes mais essentielles à la structure des macromolécules biologiques.
Les chimistes parlent également d'ions polyatomiques quand les charges ne sont pas réparties que sur un seul atome.
Certaines molécules sont acides, et il existe des acides forts (comme
Il existe également des polymères, composés de petites molécules appelées monomères et qui sont répétés. Exemple : l'amidon est un polymère de glucose.
- Si ils sont constitués d'un seul type de monomères, ils sont appelés homopolymères (ex: Glucides).
- Sinon, ce sont des hétéropolymères (ex: Protéines, Acides Nucléiques).
Les monomères sont agglomérés en polymères grâce à la condensation (libération d'eau). La réaction inverse est l'hydrolyse.
Les polymères peuvent êtres plus ou moins grands. On peut partir des dizaines de monomères au centaines de milliers.
Le terme de macromolécules est utilisé dans le monde anglo-saxon pour les polymères de très grande taille. En France, on utilise ce terme uniquement pour les polymères dont le poids moléculaire est supérieur à 10 000 daltons.
La composition moléculaire du vivant
L’eau, molécule indispensable à la vie
La constitution du vivant est principalement fondée sur le milieu aqueux réactionnel. Toutes les réactions sont donc optimisées pour ne perdre qu'un minimum d'eau. Certaines matières contiennent plus ou moins d'eau, comme la laitue à 80%. Il faut maintenir cette quantité d'eau.
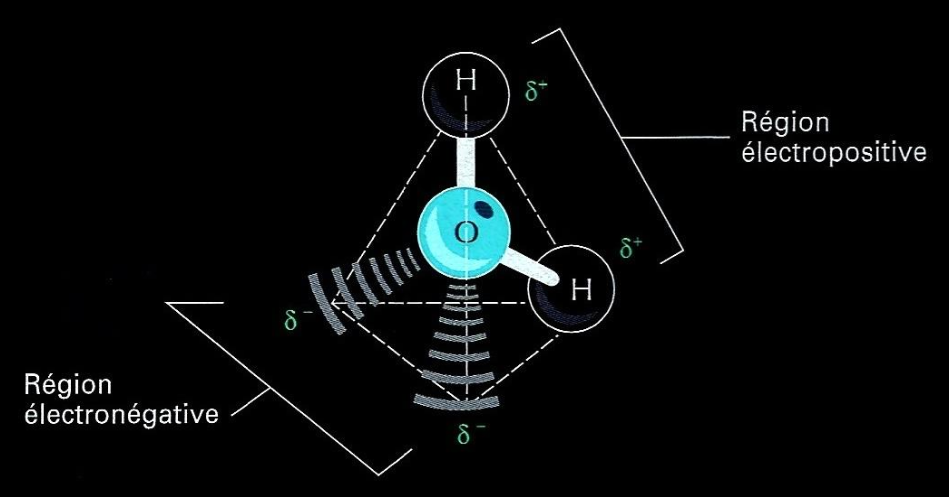
Sur ce schéma, on voit la polarité de la molécule
Il s'ensuit que l'eau est un solvant du vivant. L'eau est capable de dissoudre les molécules polaires.
Propriétés physiques biologiquement importantes
Les composés hydrophiles peuvent êtres dissous dans l'eau, car capables de faire des liaisons hydrogènes avec l'eau, contrairement aux composés hydrophobes (Lipides). Il y a également les molécules amphiphiles, à la fois hydrophiles et hydrophobes. Un exemple est les phospholipides (voir Lipides).
Quelques propriétés importantes
| Nom de la propriété | Définition | Conséquences biologiques |
|---|---|---|
| Tension superficielle | Force développée à l'interface eau-air | Cohésion de l'eau, capillarité |
| Forte chaleur de vaporisation | Énergie nécessaire pour passer de liquide à gaz | Régulation thermique (transpiration) |
| Chaleur spécifique élevée | Énergie pour augmenter la température | Tampon thermique |
Propriétés chimiques biologiquement importantes
L'eau a un PH neutre, permettant dont son utilisation dans nos organismes.
Il va falloir distinguer hydratation et hydrolyse. L'hydrolyse est l'inverse de la [condensation](#Notion de molécules), elle sépare les monomères.
Quelques propriétés importantes
| Propriété métabolique | Mécanisme et réaction impliqués | Conséquences biologiques |
|---|---|---|
| L'eau est ionisable | L'eau est autour du ph neutre (7,38 à 7,42). | |
| L'eau est un réactif | ||
| L'eau est un produit de réaction | L'eau est produite lors de réactions de biosynthèses. |
Molécules organiques
Les glucides ne sont pas des sucres, mais un grand groupe qui contient les sucres.
Polyosides
| Monomères constitutifs | Polymérisation, liaisons et polymères correspondants | Niveaux Structuraux | Rôles Principaux |
|---|---|---|---|
| Oses | Ethrifications d'oses : formation de liaisons osidiques (éther) Osidique Homopolymères | ||
| ɑ-D glucose | Liaison ɑ&-4 et ɑ 1-6 (ramifications) Glycogène des cellules animales et champignons Amidon des cellules végétales | Hélices senestres Grains d'amidon Granules de glycogène | Réserve de Glucose |
β-D-glucose | Liaison β 1-4 macromolécule de cellulose | Chaîne de cellulose Association en microfibrilles | Microfibrilles de cellulose de la paroi des cellules végétales |
| Acide glucuronique Rhamnose β-D-glucose | Pectines Hémicelluloses | Matrice de la paroi pectocellulosique | |
| Ose aminé Acide uronique | Glycosaminoglycanes |
Acides Nucléiques
| Monomères constitutifs | Polymérisation, liaisons et polymères correspondants | Niveaux Structuraux | Rôles Principaux |
|---|---|---|---|
| Nucléotides | Phosphoestérification, formation de liaisons phosphoesters Hétéropolymères | Séquences de bases azotées | |
| Désoxyribonucléotides (4 majeurs) | ADN | Structure secondaire en double hélice, tertiaire en superhélices | Support de l'information génétique |
| Ribonucléotides (4 majeurs) | ARN | ARNt structure secondaire en trèfle et tertiaire en L | ARNm intermédiaire de l'expression de l'information génétiquen ARNt et ARNr traduction |
Protéines
| Monomères constitutifs | Polymérisation, liaisons et polymères correspondants | Niveaux Structuraux | Rôles Principaux |
|---|---|---|---|
| Acides aminés (20 majeurs) | Amidification, formation de liaisons peptidiques par les ribosomes Hétéropolymères | Séquences d'acides aminés Structure secondaire, tertiaire et quatenaire pour certaines protéines | Plein. Nans mais serieux c'est quoi ces tableux. |
Les Polyosides sont équivalents aux Glucides. Ce tableau nous permet de comprendre la diversité des glucides, qui ne sont plus dans le sucre pur.
Les différents groupes sont importants car ils possèdent chacun des propriétés qui influencent ensuite les polymères. Dans certain cas, la polarité est aussi influencé.
L’importance biologique des liaisons et les interactions entre atomes et molécules
Les liaisons covalents demande de l'énergie pour êtres créées, et donc les briser en demande aussi (l'énergie peut être de l'ATP ou des biocatalyseurs comme des enzymes). Les liaisons hydrogènes sont polarisés mais peuvent ne pas être chargés. Il existe des liaisons similaires entre les cations et les anions (liaisons ioniques). Il existe également les liaisons Van der Waals entre les gaz neutres et les molécules apolaires, et enfin, les liaisons hydrophobes qui résultent de l'orientation d'une molécule apolaire dans un milieu polaire (ex: la membrane plasmique).
La mésomérie est la répartition des électrons sur l'ensemble des atomes dans une molécule.
Les principales fonctions biologiques et leurs propriétés
Bilan
Les constituants du vivant sont organiques ou minéraux, présents en quantités plus ou moins importantes. L'eau en représente 70%. C'est un dipôle fluide, fruit de beaucoup de réactions Chaque molécule possède son propre groupe et ses propriétés. Enfin, ces réactions forment d'autres molécules avec d'autres propriétés. Toutes ces réactions sont liés au couches d’électrons.
Réduit: liaison simples partout. Checkup mistral
